Entre todas las ramas de la física que se han vuelto populares en este último tiempo, sin lugar a duda la mecánica cuántica ocupa un lugar especial entre ellas. En esta área se estudia la naturaleza a escalas del orden de sistemas atómicos, partículas subatómicas y las interacciones que tienen entre sí.
El universo visible consiste en más o menos 100 elementos distintos. Sin embargo, a diario es posible encontrar innumerables compuestos químicos en un espacio tan cotidiano como el escritorio de cualquier oficinista. Esto sucede porque naturalmente es muy difícil encontrar átomos que se encuentren solos. Normalmente éstos se encuentran en distintas combinaciones con átomos de otros elementos o en pares de su mismo elemento, mediante enlaces químicos. A raíz de este hecho la pregunta obvia es: ¿Por qué el universo no está lleno sólo de estos 100 átomos diferentes, en vez de la infinidad de compuestos químicos que lo habitan?
La respuesta radica en entender el papel que juega la energía en la formación de moléculas y sus fundamentos en la mecánica cuántica.
Muchas de las sustancias más importante para nosotros, como el aire, por ejemplo, consiste no en átomos individuales sino en compuestos. El oxígeno, no se encuentra en la naturaleza de forma individual, sino que como dos átomos enlazados entre si (O2), al igual que el nitrógeno (N2) o compuestos más complejos como la molécula de agua (H2O). Los sistemas recién nombrados, al igual que el resto, tienden a adoptar el estado de mínima energía. Para entender mejor esto. Lo llevaremos al siguiente ejemplo:
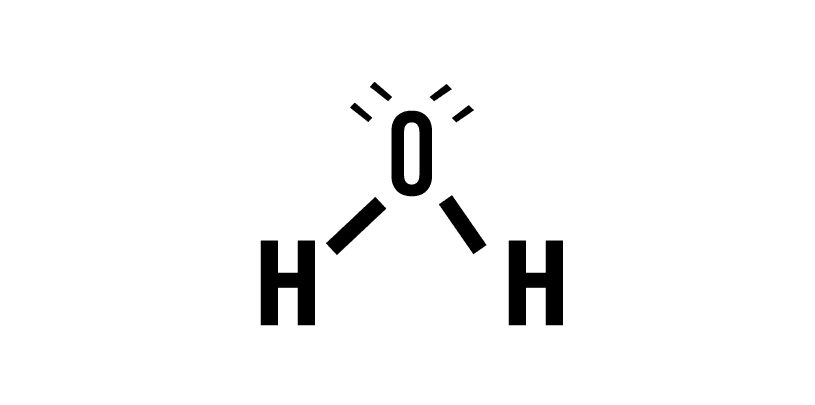
El átomo de hidrógeno por sí solo estará en su estado de energía más bajo, llamado estado fundamental. Pero cuando se introduce un segundo átomo de hidrógeno, comienzan a suceder fenómenos interesantes. Ambos átomos están en su respectivo estado fundamental, pero a medida que se acercan, sus electrones y protones comienzan a generar atracciones y repulsiones debido a sus respectivas cargas eléctricas. Todas estas interacciones tienen una energía asociada a tomar en cuenta para calcular el estado de mínima energía, las cuales son determinadas por la ecuación de Schrödinger.
Si bien la ecuación de Schrödinger define los estados de mínima energía, no es trivial de resolver y es necesario aplicar muchas herramientas matemáticas para generar conclusiones a partir de ella. Un hecho de gran relevancia que se puede apreciar de las soluciones a la ecuación radica en que el estado de energía de un sistema de dos átomos es menor que la energía de dos sistemas separados de un átomo. Esta es la razón por la que, si dos átomos de hidrógeno están cerca uno del otro, naturalmente se combinarán para formar una molécula de H2.
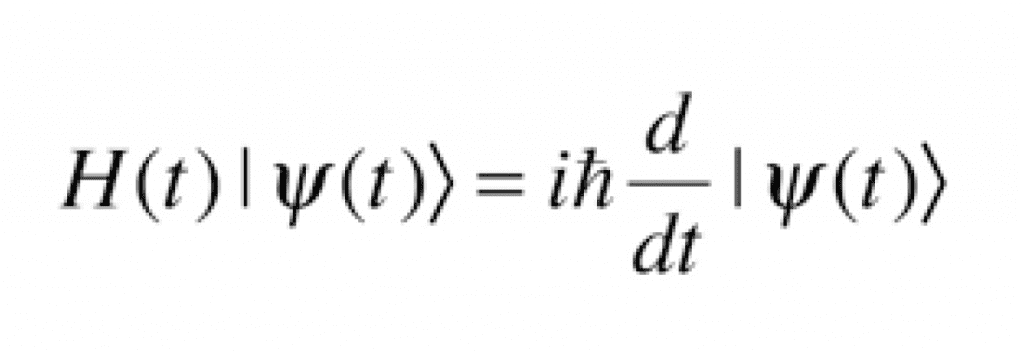
Pero no todos los elementos forman enlaces con átomos de su propio tipo, ni con cualquier otro átomo. Todas las sustancias se esfuerzan por lograr una estabilidad al compartir o tener una cantidad específica de electrones: 2, 10, 18, 36, 54 u 86 en los orbitales alrededor del núcleo. Estos números corresponden al número de electrones contenidos en los 6 gases nobles.
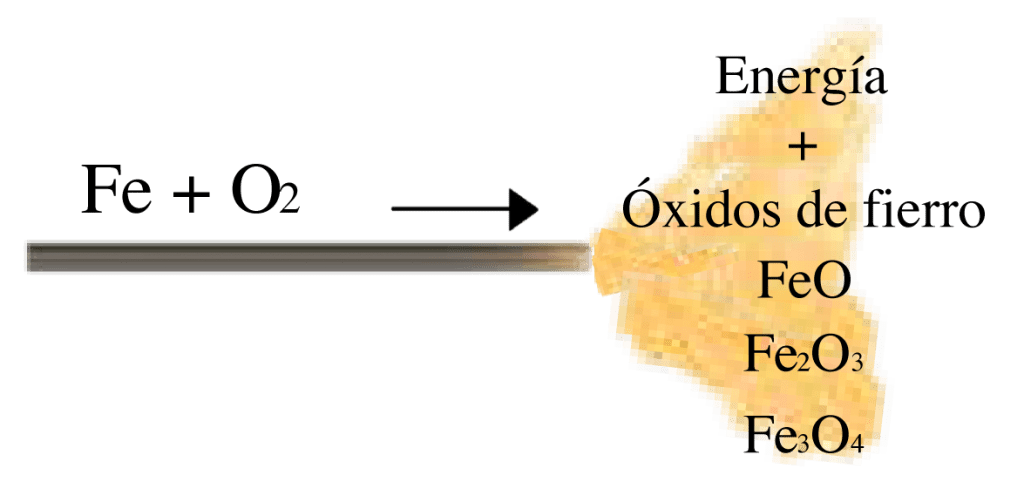
En particular el hierro tiende a compartir los electrones sobrantes en su capa más externa en un proceso de oxidación. Esto da espacio a varios tipos de óxidos de hierro donde cada uno tiene un nivel de estabilidad distinto al otro y se acerca más al estado de mínima energía. El estado del compuesto resultante tiene tan poca energía comparado con los estados iniciales, que como resultado de esta reacción se libera una gran cantidad de energía al ambiente. A esto se le llama comúnmente reacción exotérmica. Los niveles de energía son tal que un metro cubico de hierro puede llegar a liberar 57 447 000 kilo Joules, si este se oxida a su estado de menor energía (Fe2O3), energía suficiente para alimentar el motor de un camión de 25 toneladas de carga durante un viaje de 4268 kilómetros (a lo largo de todo Chile).
Si bien en el caso de más arriba se habla en que se podrían aprovechar los estados de oxidación del hierro para utilizar la energía liberada (energía mecánica), hay casos más aterrizados en donde se utiliza esta energía exotérmica, y es el caso de las lanzas térmicas
Al hacer convivir oxígeno diatómico con acero de bajo carbono se promueve la oxidación de este último. Aunque el proceso de oxidación del acero en general es un proceso que no es espontáneo, al inyectar energía al sistema, los electrones de valencia (electrones de la última capa) se excitan, siendo mas propensos a reaccionar, logrando el estado de menor energía de manera más violenta, volviéndose así la reacción espontánea.
La energía liberada en las lanzas térmicas se utiliza para fundir distintos materiales que se quieran perforar o cortar, y como resultado de la reacción de esta misma se obtienen óxidos de fierro y energía calórica. Se pueden obtener distintos óxidos dado que, como todos los procesos o sucesos descritos en mecánica cuántica, estos son probabilísticos, por lo que, aunque una gran mayoría del hierro tienda a ir al estado de menor energía (Fe2O3), otras partículas de hierro pasarán por un estado de oxidación intermedio antes del final, o incluso no llegarán al estado de mínima energía (grados de menor oxidación).
Aunque la mecánica cuántica, que está detrás de todos estos fenómenos, nos permite ver cómo se comporta la naturaleza, no explica por qué ésta es como es. La pregunta ¿Por qué las cosas funcionan en el modo en que lo hacen? y es una de las más interesantes a responder, donde muchos científicos han dedicado gran parte de su vida.
Richard Feynmann (Premio nobel de física en 1965) dijo una vez “Creo que puedo decir con seguridad que nadie entiende la mecánica cuántica”, frase que hasta el día de hoy no ha podido ser refutada. Sin embargo, esto no ha sido motivo para dejar de lado esta maravillosa rama de la física, que hasta el día de hoy ha permitido determinar fenómenos que han hecho posibles muchos desarrollos de Ingeniería, como lo son la teorización de todos los combustibles líquidos y combustibles sólidos, incluidas las lanzas térmicas.

